Тесты по химии 11 класс. Тема: "Гидролиз"
Правильный вариант ответа отмечен знаком +
1. Какое из приведённых ниже кратких определений принадлежит понятию «гидролиз»?
- замещение аминогруппы
- выделение веществ на электродах
- разложение воды фотонами
+ разложение соединений с участием воды
2. Гидролизу подвергаются:
- только неорганические соединения
+ органические и неорганические соединения
- только органические соединения
- исключительно соли
3. Какие вещества образуются в результате гидролиза высокомолекулярных соединений - галогеналканов?
- щёлочь
- моносахариды
- аминокислоты
+ спирты
4. Примером диссоциации кислоты, являющейся слабым электролитом, будет:
- H2SO4 ↔ 2H+ + HSO42-
- HNO3 ↔ H+ + NO3-
+ H2CO3 ↔ H+ + HCO3-
- HCl ↔ H+ + Cl-
5. Количество гидроксид-ионов определяет кислотность основания. Двухкислотным основанием является:
+ Ca(OH)2
- KOH
- NaOH
- Al(OH)3
6. Если гидролиз идёт по катиону и разрушается остаток основания, то среда будет:
- щелочной
+ кислой
- нейтральной
- слабощелочной
7. Обычно, гидролиз – обратимый процесс, но существуют два исключения, когда соли образованы:
- сильной кислотой и слабым основанием, слабой кислотой и сильным основанием
- слабой кислотой и слабым основанием, сильной кислотой и слабым основанием
- слабой кислотой и сильным основанием, сильной кислотой и сильным основанием
+ сильной кислотой и сильным основанием, слабой кислотой и слабым основанием
8. При разбавлении раствора равновесие смещается вправо, и гидролиз усиливается, а при увеличении ионов водорода равновесие смещается влево, и гидролиз ослабевает. Это соответствует:
- закону кратных отношений
- закону Гей-Люссака
- правилу постоянства химического состава
+ принципу Ле Шателье
9. Гидролиз является разновидностью:
- аммонолиза
- алькоголиза
- гидратации
+ сольволиза
тест 10. На иллюстрации изображён продукт, который получают с помощью гидролиза. Гидролиза каких веществ?

- галогеналканов
- углеводов
- белков
+ жиров
11. Что образуется в результате обменных реакций ионов соли и воды?
- сильный электролит
+ слабый электролит
- сильный или слабый электролит (зависит от типа соли)
- сильный или слабый электролит (зависит от характера среды)
12. Какие соли не подвергаются гидролизу из-за наличия гидратных оболочек?
- образованные слабой кислотой и сильным основанием
- образованные сильной кислотой и слабым основанием
- образованные слабой кислотой и слабым основанием
+ образованные сильной кислотой и сильным основанием
13. Если гидролиз идёт по аниону, то для него характерны:
- ступенчатость, слабокислая среда, обратимость
+ ступенчатость, слабощелочная среда, обратимость
- нейтральная среда, необратимость
- необратимость
14. Если гидролиз идёт по катиону, то для него характерны:
- ступенчатость, слабощелочная среда, обратимость
+ ступенчатость, слабокислая среда, обратимость
- необратимость
- нейтральная среда, необратимость
15. Гидролиз соли, которая образована слабым основанием и слабой кислотой идёт по:
- катиону
- аниону
+ катиону и аниону
- такая соль не гидрализируется
16. На иллюстрации изображён гидролиз, конечными продуктами которого являются моносахариды и ортофосфорная кислота. Какие вещества в данном случае подвергаются гидролизу?
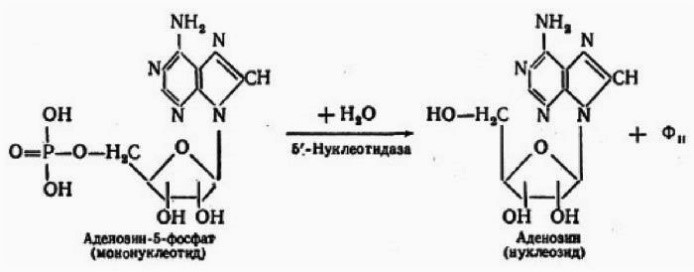
- белки
- углеводы
- жиры
+ нуклеиновые кислоты
17. Гидролиз белков – это:
+ разрушение первичной структуры в водном или щелочном растворе с образованием свободных аминокислот
- разрушение первичной и вторичной структуры щелочном растворе с образованием аминокислот
- разрушение первичной структуры в водном растворе
- разрушение первичной структуры в водном растворе с образованием свободных аминокислот
18. Гидролиз соли NaCl (хлорид натрия) не происходит, потому что:
- она образована нерастворимым основанием
- она является нерастворимой
- она образована слабой кислотой и слабым основанием
+ она образована сильной кислотой и сильным основанием
19. Что из приведённого ниже не усиливает гидролиз?
+ увеличение концентрации растворённого вещества
- увеличения концентрации растворителя
- нагревание
- связывание продукта в труднорастворимое соединение
тест-20. Что из приведённого ниже не подавляет гидролиз?
- подщелачивание
- охлаждение
+ удаление продукта в газовую фазу
- увеличение концентрации растворителя
21. Алкоголята являются производными спиртов, при гидролизе они распадаются на:
- спирты и карбоновые кислоты
- спирты
- глицерин и соли карбоновых кислот
+ спирты и щёлочь
22. Константа гидролиза показывает способность вещества подвергаться электролитической диссоциации. Для каких гидролитических процессов она характерна?
- обратимых (по катиону и аниону)
- необратимых (по катиону и аниону)
+ обратимых (по аниону, по катиону)
- необратимых (только по катиону)
23. Продолжите фразу: образованные при гидролизе солей слабые электролиты...
- практически мгновенно распадаются ионы
+ практически не распадаются на ионы
- не способны распадаться на ионы
- выпадают в осадок и не распадаются на ионы
24. К специальным случаям гидролиза относиться соль:
+ NH4NO3
- AlCl3
- CH3COONa
- (NH4)2S
25. Степень гидролиза – это:
- отражение равновесия реакции
- совокупность концентрации анионов и катионов
- процентное соотношение катионов и анионов
+ отношение количества подвергшихся гидролизу молекул электролита к общему числу молекул электролита
26. В 1888 году Вильгельм Оствальд установил закон разбавления веществ, позволявший определять константы диссоциации. Какие количественные показатели гидролиза взаимосвязаны через уравнение Оствальда?
- концентрация и растворимость
- концентрации анионов и катионов
+ константа и степень
- количество начальных и конечных продуктов
27. Чтобы избежать хлороза у растений, в почву с пониженной кислотностью вносят (NH4)2SO4. pH почвы снижается благодаря гидролизу:
- по аниону
+ по катиону
- по катиону и аниону
- зависит от конкретной pH
28. Ступенчатый гидролиз наблюдается в случае, когда соль образована:
- однокислотным основанием или одноосновной кислотой
- двухкислотным основанием и двухосновной кислотой
+ многокислотным основанием или многоосновной кислотой
- в любом случае
