Тесты по химии 11 класс. Тема: "Электролиз"
Правильный вариант ответа отмечен знаком +
1. Что включает в себя понятие «электролиз»?
- реакция разложения вещества с участием воды
- реакция разложения между растворенным веществом и растворителем
- обменные реакции между органическими веществами
+ окислительно-восстановительные реакции на электродах
2. Где может протекать электролиз?
- только в растворах электролитов
- только в расплавах электролитов
+ в растворах и расплавах электролитов
- не принципиально
3. Главная особенность электролиза заключается в том, что:
- полуреакции разделены во времени
+ полуреакции разделены в пространстве
- полуреакции разделены во времени и пространстве
- на одном электроде происходят и окисление, и восстановление
4. Анод является важной составной частью электролиза, им называют:
- отрицательно заряженный электрод
+ положительно заряженный электрод
- раствор электролита
- расплав электролита
5. В процессе электролиза на катоде происходит реакция:
- окисления
- обмена
- замещения
+ восстановления
6. Какие окислители восстанавливаются на одном из электродов?
- ионы неметаллов
- вода
+ ионы металлов и вода
- азотная кислота
7. Сильные окислители характеризуются:
- наименьшим стандартным потенциалом
+ наибольшим стандартным потенциалом
- способностью реагировать без остатков
- ничем из всего вышеперечисленного
8. Чем определяются продукты катодных реакций электролиза?
- положением элемента в главной подгруппе
- номером в периодической таблице
- относительной атомной массой
+ положением металла в ряду напряжений
9. В случае, когда металл стоит правее водорода в ряду напряжений, восстанавливаются:
- вода с выделением водорода
- металл и водород
+ ионы металлов
- атомы кислорода
тест 10. Если металл стоит левее алюминия, то восстанавливаются:
- ионы металлов
+ вода с выделением водорода
- металл и водород
- атомы кислорода
11. Если в ряду напряжений металл расположен между алюминием и водородом, то какие вещества могут выделяться на катоде:
+ метал и водород
- вода и водород
- вода и кислорода
- метал и кислород
12. На нерастворимом положительном электроде будут окисляться:
- ионы металлов и вода
+ ионы кислотных остатков, гидроксид-ионы и вода
- вода
- ионы кислотных остатков и гидроксид-ионы
13. Наиболее сильные восстановители реагируют первыми, потому что они характеризуются:
- наибольшим стандартным потенциалом
+ наименьшим стандартным потенциалом
- способностью реагировать без остатков
- ничем из всего вышеперечисленного
14. Что окисляется в случае, когда ионы кислотного остатка содержат атомы кислорода?
- сами ионы кислотного остатка
- вода
+ вода или ионы OH-
- материал анода
15. Какой из перечисленных ниже материалов анода является нерастворимым.
- медь
+ графит
- цинк
- никель
16. С помощью уравнения электродных реакций можно определить количество веществ, выделившихся на электродах. При этом используется постоянная Фарадея, равная заряду одного моля электронов, то есть:
- 8,314 Дж/моль∙К
- 6,626∙10-34 Дж∙С
- 1,6∙1019 Кл
+ 9,648∙104 Кл/моль
17. Выберите верную формулировку первого закона Фарадея.
+ масса вещества, образующегося на электроде, прямо пропорциональна количеству пропущенного электричества
- для разряда одного моля ионов на электроде необходимо пропустить через электролит количество электричества, равное заряду иона, умноженному на постоянную Фарадея
- сила тока в проводнике прямо пропорциональна напряжению на его электродах
- производящаяся электродвижущая сила пропорциональна скорости изменения магнитного потока
18. Для данного количества электричества масса вещества, выделившегося на электроде, прямо пропорциональна эквивалентной массе вещества. Это формулировка:
- первого закона Фарадея
+ второго закона Фарадея
- закона Оствальда
- закона Джоуля-Ленца
19. На иллюстрации изображён пример гальваностегии – одного из способов применения электролиза, который получается путём:

- получения копий из цветного металла при помощи осаждения его из раствора или расплава под действием электрического тока на матрице, а также покрытием металлом неметаллических предметов
- очисткой металлов от примесей электролизом с применением растворимого анода
+ нанесения металлических покрытий на поверхность металлических изделий для защиты от коррозии или для декоративного вида
- получением активных металлов электролизом расплавов природных соединений
тест-20. На схеме, приведённой ниже, показан электролиз расплава хлорида натрия. Что отмечено знаком вопроса?
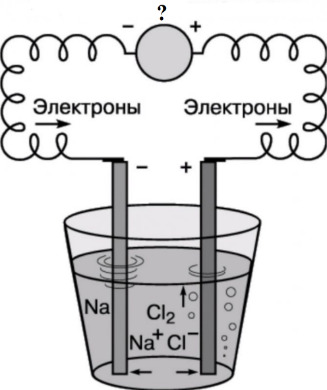
- положительно заряженный электрод
- отрицательно заряженный электрод
- полупроницаемая мембрана
+ источник постоянного тока
21. Процессы, происходящие на аноде, зависят от:
- положения металла в электрохимическом ряду напряжений
- только от материала
- только от природы аниона
+ материала и природы аниона
22. Что восстанавливается при электролизе катиона аммония NH4+:
+ вода
- анион кислотного остатка
- алкан
- углекислый газ
23. С помощью электролиза были обнаружены многие элементы периодической систему. В 1807-1808 гг. Хамфри Дэви во время своих экспериментов открыл:
- олово, цинк, сурьму
- литий, фтор, галлий
- водород, кислород
+ калий, натрий, барий, кальций, магний
24. В процессе электролиза под действием постоянного тока движение ионов к соответствующим противоположно заряженным электродам становится:
- хаотичным
+ направленным
- замедляющимся
- сначала упорядоченным, затем хаотичным
25. Кто из перечисленных ниже учёных не занимался изучением электролиза?
+ Лайнус Полинг
- Энтони Карлайл
- Уильямом Томасом Бранде
- Фердинанд Фредерик Анри Муассан
26. Какой из перечисленных ниже факторов электролиза способен не только ускорить процесс, но также повысить активность примесей?
- кислотность среды (электролита)
- напряжение металла
+ температура
- плотность и сила тока
27. При анодировании металлическая деталь, которая нуждается в покрытии, устанавливается вместо анода. Таким образом, на аноде во время электролиза оседает слой:
+ неметаллических соединений
- металлических соединений
- раствора электролита
- расплава металла
