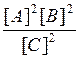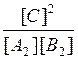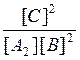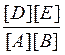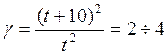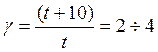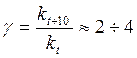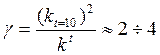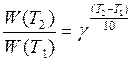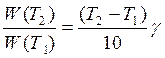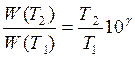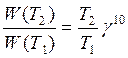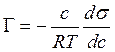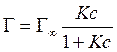Тест Химическое равновесие
|
№ |
Содержание задания |
Вариант ответа |
|||
|
А |
Б |
В |
Г |
||
|
6.1 |
Понятие «равновесие» означает состояние, в котором… |
Количества реагентов равны количествам продуктов реакции |
Концентрации веществ не изменяются со временем и отсутствуют потоки массы и энергии |
Массы продуктов реакции равны массам исходных веществ |
Внутренняя энергия равна нулю |
|
6.2 |
Состояние химического равновесия характеризуется тремя обязательными признаками. Это… |
Нулевое значение энергии активации; открытая химическая система; положительный тепловой эффект |
Положительное значение энергии активации; присутствие катализатора; равенство скоростей прямой и обратной реакций |
Изолированная система; равенство скоростей прямой и обратной реакций; отсутствие видимых изменений в системе |
Закрытая система; равенство скоростей прямой и обратной реакций; нулевое значение энергии активации |
|
6.3 |
Химическое равновесие называют динамическим, потому что… |
Два противоположных процесса оказываются сбалансированными |
В результате совершается работа |
В результате поглощается или выделяется энергия |
Два противоположных процесса протекают с одинаковыми скоростями |
|
6.4 |
Химические реакции, протекающие в противоположных направлениях, называют… |
Кинетическими |
Термохимическими |
Обратимыми |
Каталитическими |
|
6.5 |
В химической литературе иногда встречается жаргонное утверждение: «химическая реакция не всегда доходит «до конца»; оно означает, что… |
Исходные вещества лишь частично превращаются в продукты реакции |
Реакция обратима |
Исходные вещества полностью израсходовали внутреннюю энергию |
Продукты реакции начинают оказывать ингибирующее действие |
|
6.6 |
Состояние химического равновесия обратимых процессов количественно характеризуют… |
Равновесными концентрациями продуктов реакции |
Константой Больцмана |
Константой равновесия |
Энергией активации |
|
6.7 |
При достижении химического равновесия концентрации веществ… |
Не изменяются |
Увеличиваются для продуктов и уменьшаются для исходных веществ |
Не могут быть определены |
Достигают одинаковых значений |
|
6.8 |
Изменения, происходящие в обратимой химической системе, определяются Принципом подвижного равновесия, называемым … |
Правилом Аррениуса |
Принципом запрета Паули |
Принципом Ле-Шателье |
Законом Гесса |
|
6.9 |
Принцип подвижного равновесия утверждает, что внешнее воздействие на равновесную систему приводит к смещению равновесия в том направлении, при котором эффект произведенного воздействия ослабляется. При этом подразумевается три типа внешнего воздействия: |
Давление, объем, катализатор |
Давление, концентрация, объем |
Температура, концентрация, давление |
Температура, давление, катализатор |
|
6.10 |
Выход реакции велик в том случае, если… |
Константа равновесия К >> 1 |
Константа равновесия К<< 1 |
Используется катализатор |
Используется ингибитор |
|
6.11 |
Смешали по 4 моля веществ А, В,С и D. После установления равновесия А + В ↔ С + D в смеси обнаружили 2 моля вещества А. Рассчитайте константу равновесия. |
9 |
25 моль |
4 |
1 моль |
|
6.12 |
Константа скорости прямой реакции равна 625 л/(моль. с), а обратной реакции равна 5 л/(моль. с). Какое из уравнений химических реакций описывает данное равновесие? |
А = В + С |
2А = В |
А + В = 2С |
А + В = С |
|
6.13 |
Как изменяется константа равновесия при повышении температуры? |
Уменьшается |
Увеличивается для эндотермических реакций и уменьшается для экзотермических |
Увеличивается |
Сначала увеличивается, а затем уменьшается |
|
6.14 |
Известно, что теплота превращения графита в алмаз не велика: С(графит) ↔С(алмаз) -1,9 кДж. Казалось бы, в таком случае при нагревании легко осуществить синтез искусственных алмазов. Однако для реального сдвига равновесия даже высокой температуры оказывается недостаточно. И тогда исследователи обратили внимание на следующий факт: плотность алмаза (3,5 г/см3) больше плотности графита (2,2 г/см3). Следовательно, чтобы сместить равновесие вправо в реакции образования алмаза, необходимо… |
Значительно уменьшить давление, поскольку графит занимает меньший объем, чем алмаз |
Значительно увеличить давление, поскольку алмаз занимает меньший объем, чем графит |
Использовать катализатор |
Значительно понизить температуру |
|
6.15 |
Константа равновесия связана с термодинамическими функциями: энтальпией, энтропией, свободной энергией Гиббса. Какое уравнение отражает связь константы равновесия с энергией Гиббса при стандартных условиях? |
ΔG = -19,1 T lg Kc |
ΔG = - RT ln Kc |
ΔG = ln Kc/RT |
ΔG = - RT/ln Kc |
|
6.16 |
Температура начала реакции – это температура, при которой ΔG = 0. По какой формуле можно определить эту температуру? |
Т = ΔH. ΔS |
T = ΔH / ΔS |
T = ΔS / ΔH |
T = R ΔH / ΔS |
|
6.17 |
Для реакций, протекающих в газовой фазе, константа равновесия записывается через парциальные давления реагирующих веществ Кр. Как связаны между собой константы, выраженные через концентрации Кс и через парциальные давления Кр. (Δ n – разность между числом молей газообразных веществ в правой и левой частях уравнения) |
Кр = Δn Кс / RT |
Kp = Kc (RT) Δn |
Kp = RT Kc /Δn |
Kp = Kc Δn |
|
6.18 |
Какое значение свободной энергии Гиббса предполагает наступление равновесия в закрытой системе? |
ΔG > 0 |
ΔG < 0 |
ΔG = 0 |
ΔG не является критерием наступления равновесия |
|
6.19 |
В каком направлении сместится равновесие при повышении давления в системе NO + Cl2 ↔ 2NOCl2 ? |
Вправо |
Влево |
Не сместится |
- |
|
6.20 |
Как следует изменить давление в системе 2СО+О2↔ 2СО2, чтобы сместить равновесие реакции вправо? |
Повысить |
Понизить |
Оставить без изменения |
- |
|
6.21 |
В каком направлении сместится равновесие при повышении температуры в системе H2 + Cl2 ↔ 2HCl, ΔH< 0 ? |
Вправо |
Влево |
Не сместится |
- |
|
6.22 |
Как следует изменить температуру в системе SO2 + ½ O2 ↔ SO3 + Q, чтобы сместить равновесие вправо? |
Повысить |
Понизить |
Оставить без изменения |
- |
|
6.23 |
Как повлияет увеличение концентрации второго компонента на смещение химического равновесия в системе: CO(г.) + 3 Fe2O3(тв.) ↔ 2Fe3O4(тв.) + CO2(г.)? |
Равновесие сместится вправо |
Равновесие сместится влево |
Не повлияет на смещение равновесия, так как это твердое вещество |
- |
|
6.24 |
Константы равновесия химической реакции А2(г.) + В2(г.) ↔ 2С(г.) описываются уравнением… |
|
|
|
K [A2][B2] |
7. Химическая кинетика и катализ
|
№ |
Содержание задания |
Варианты ответа |
|||
|
А |
Б |
В |
Г |
||
|
7.1 |
Скорость химической реакции – это… |
Время, за которое полностью расходуется одно из исходных веществ |
Время, за которое заканчивается реакция |
Изменение количества вещества реагентов или продуктов реакции в единицу времени в единице объема |
Количество вещества продуктов реакции к моменту окончания реакции |
|
7.2 |
От каких факторов не зависит скорость химических реакций в растворе? |
От природы реагирующих веществ |
От концентрации реагирующих веществ |
От температуры |
От объема реакционного сосуда |
|
7.3 |
В каких единицах выражается скорость химической реакции? |
Моль. л-1.с-1 |
Молекула. см-3.с-1 |
Моль2.с |
Безразмерная величина |
|
7.4 |
Зависимость скорости реакции общего типа аА + bВ → dD + eE от концентрации описывается основным постулатом химической кинетики – законом действующих масс. Его математическое выражение: |
W = k[A][B] |
W = k[A]a[B]b |
W = k[A]x[B]y |
W = k |
|
7.5 |
Константа скорости k в законе действующих масс – это… |
Скорость реакции при единичных концентрациях реагирующих веществ |
Безразмерный коэффициент пропорциональности между скоростью и концентрациями |
Коэффициент в уравнении Вант - Гоффа |
Изменение концентрации вещества к моменту окончания реакции |
|
7.6 |
Числа x и y в законе действующих масс ( см. задание 4) - это… |
Стехиометрические коэффициенты химической реакции |
Молекулярность реакции |
Формальные числа, которые называют порядком реакции по веществам А и В |
«Описка» - вместо x и y в законе действующих масс должны стоять коэффициенты а и b |
|
7.7 |
Общий порядок реакции – это… |
Сумма показателей степеней в кинетическом уравнении |
Число молекул, участвующих в реакции |
Порядок приливания реагирующих веществ |
Сумма коэффициентов в уравнении реакции |
|
7.8 |
Показатели степени x и y в законе действующих масс редко совпадают со стехиометрическими коэффициентами а и b в химической реакции аА + bВ → dD + eE. Совпадение бывает в случае, если… |
Реакция протекает чрезвычайно медленно |
Реакция является элементарной |
Реакция протекает по цепному механизму |
Реакция протекает в присутствии катализатора |
|
7.9 |
Элементарная реакция – это… |
Реакция, которую нельзя 2разбить» на более простые реакции |
Единичный акт разрыва и (или) образования химических связей, протекающий через образование переходного комплекса |
Реакция, протекающая в присутствии катализатора |
Реакция, протекающая с выделением теплоты |
|
7.10 |
Большинство химических реакций состоит из нескольких элементарных реакций, называемых иногда элементарными стадиями. Число частиц, одновременно участвующих в элементарной реакции, называют… |
Общим порядком реакции |
Переходным комплексом реакции |
Стехиометрией процесса |
Молекулярностью реакции |
|
7.11 |
Какие из перечисленных величин могут принимать отрицательные значения? |
Скорость химической реакции |
Порядок реакции |
Молекулярность реакции |
Константа скорости |
|
7.12 |
Какие из перечисленных величин не могут принимать дробные значения? |
Скорость химической реакции |
Порядок реакции |
Молекулярность реакции |
Константа скорости |
|
7.13 |
Ни одна химическая реакция не протекает мгновенно. Во всех реакциях между реагентами и продуктами существует некоторое переходное состояние или переходный (активированный) комплекс. Переходное состояние – это… |
Уже не реагенты, но еще не продукты |
Продукт, полученный под воздействием излучения |
Непрерывная совокупность всех конфигураций ядер, соответствующих переходу от реагентов к продуктам |
Реагент, обладающий самой низкой энтальпией образования |
|
7.14 |
Установите соответствие: порядок реакции – размерность константы скорости. А) нулевой, Б) первый, В) второй, Г) третий |
С-1 |
Л/(моль. с) |
Л2/(моль2.с) |
Моль/(л. с) |
|
7.15 |
Установите соответствие: порядок реакции – кинетическое уравнение А) нулевой, Б) первый, В) второй |
C = co - kt |
1/c = 1/co + kt |
Ln c = ln co - kt |
- |
|
7.16 |
Установите соответствие: порядок реакции – период полупревращения. t1/2 А) нулевой, Б) первый, В) второй |
Co/2k |
1/kco |
Ln 2/k |
- |
|
7.17 |
Как изменится скорость газофазной элементарной реакции А = 2В при увеличении давления в закрытом сосуде в 3 раза? |
Не изменится |
Уменьшится в 6 раз |
Увеличится в 3 раза |
Увеличится в 9 раз |
|
7.18 |
Для приближенной оценки измерения скорости реакции используют эмпирическое правило Вант – Гоффа, согласно которому при повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2 – 4 раза. Это правило было установлено для реакций при невысоких температурах и связано с понятием Температурного коэффициента скорости реакции γ, определяемого соотношением: |
|
|
|
|
|
7.19 |
Зная температурный коэффициент скорости, можно оценить изменение скорости реакции при увеличении температуры от Т1 до Т2 по формуле: |
|
|
|
|
|
7.20 |
Согласно Аррениусу, константа скорости зависит от температуры экспоненциально |
С размерностью температуры |
Она безразмерна |
С размерностью константы скорости |
С размерностью энергии активации |
|
7.21 |
Энергия активации – это… |
Энергия, необходимая для перехода вещества в состояние активированного комплекса |
Энергия, которую необходимо затратить для измельчения исходных веществ |
Энергия, которая выделяется в результате химической реакции |
Разница между энергиями исходных веществ и продуктов реакции |
|
7.22 |
Какое из утверждений неверно? Согласно теории активных соударений, для химического взаимодействия А + В = Продукты молекулы должны: |
Встретиться |
Быть определенным образом ориентированными |
Иметь неспаренные электроны |
Обладать достаточным запасом энергии |
|
7.23 |
Во сколько раз увеличится скорость реакции при повышении температуры от 40 до 80 оС, если температурный коэффициент скорости равен 2? |
В 4 раза |
В 16 раз |
В10 раз |
В 2,5 раза |
|
7.24 |
В каком из двух случаев константа скорости реакции увеличивается в большее число раз: при нагревании от 0 до 10оС или при нагревании от 283 до293К? Ответ обоснуйте с помощью уравнения Аррениуса. |
Изменение константы в каждом случае одинаково |
Во втором случае |
Константа не изменяется в обоих случаях |
В первом случае |
|
7.25 |
Энергия активации некоторой реакции в 3 раза больше, чем энергия активации другой реакции. При нагревании от Т1 до Т2 константа скорости второй реакции увеличилась в х раз. Во сколько раз увеличилась константа скорости первой реакции при таких же условиях? |
В х3 раз |
В х раз |
В 3х раз |
В х1/3 раз |
|
7.26 |
Какие вещества называют катализаторами? |
Образующие высокомолекулярные соединения |
Изменяющие скорость химической реакции, но остающиеся неизменными после окончания реакции |
Эффективно поглощающие радиоактивное излучение |
Способствующие ускорению прямой реакции |
|
7.27 |
В чем заключается механизм действия катализатора? |
Он изменяет путь процесса «реагенты – продукты», причем новый путь характеризуется меньшей энергией активации |
Он уменьшает тепловой эффект химической реакции |
Он понижает начальную энергию реагентов |
Он ускоряет образование активированного комплекса |
|
7.28 |
Как влияет температура на скорость ферментативных реакций? |
Скорость реакции возрастает с ростом температуры в любом интервале температур |
Скорость ферментативных реакций не зависит от температуры |
Ферменты обладают наибольшей активностью при температурах живого организма (35 – 40 оС). При температурах выше 50- 60 оС они, как правило, разрушаются и становятся неактивными – скорость реакции резко падает. |
При повышении температуры скорость ферментативной реакции всегда понижается |
|
7.29 |
Как называются вещества: А) представляющие собой специфические белки, выполняющие каталитические функции в живых системах; Б) замедляющие ход химических реакций, участвующие в промежуточных стадиях, но регенирирующиеся к моменту образования продуктов; В) усиливающие действие катализатора и увеличивающие его селективность; Г) представляющие собой активную небелковую группу в составе биологического катализатора |
Промоторы |
Ферменты |
Коферменты |
Ингибиторы |
|
7.30 |
Какие из перечисленных свойств не присущи катализаторам? |
Одинаково ускоряют прямую и обратную реакции |
Влияют на механизм реакции |
Изменяют положение равновесия реакции |
Влияют на общую стехиометрию реакции |
|
7.31 |
Какое свойство не характерно для ферментов? |
Зависимость от рН среды |
Узкий диапазон рабочих температур |
Инактивация |
Независимость от конфигурации и строения |
Тестирование по химии по теме Поверхностные явления и адсорбция
|
№ |
Содержание задания |
Варианты ответа |
|||
|
А |
Б |
В |
Г |
||
|
8.1 |
Избирательное поглощение вещества из раствора или газовой смеси всем объемом адсорбента (жидкостью или твердым телом) называется… |
Адсорбция |
Абсорбция |
Сорбция |
Хемосорбция |
|
8.2 |
Поглощение газов, паров и растворенных веществ твердыми телами или жидкостями называется… |
Адсорбция |
Абсорбция |
Сорбция |
Хемосорбция |
|
8.3 |
Поглощение вещества из газовой смеси или жидкой среды поверхностным слоем твердого тела или жидкости называется… |
Адсорбция |
Абсорбция |
Сорбция |
Хемосорбция |
|
8.4 |
Поглощение вещества за счет образования химических связей между молекулами вещества и сорбента называется… |
Адсорбция |
Абсорбция |
Сорбция |
Хемосорбция |
|
8.5 |
Мерой удельной избыточной свободной поверхностной энергии является… |
Адсорбция |
Поверхностное натяжение |
Диэлектрическая проницаемость |
Дипольный момент |
|
8.6 |
Мерой избыточного содержания компонента в поверхностном слое является… |
Адсорбция |
Поверхностное натяжение |
Диэлектрическая проницаемость |
Дипольный момент |
|
8.7 |
Поверхностное натяжение – важнейшая молекулярная константа жидкости, характеризующая межмолекулярное сцепление. Какое из определений не отражает физический смысл этого понятия? |
Работа образования единицы поверхности |
Работа переноса молекул из объема тела на поверхность |
Работа переноса молекул из поверхностного слоя в объем жидкости |
Работа разрыва столбика жидкости |
|
8.8 |
В гетерогенных системах различают межмолекулярные взаимодействия внутри фаз (когезия) и между фазами (адгезия). Их характеризуют те же параметры, что и величину поверхностного натяжения: энергия кристаллической решетки, температура кипения, летучесть и т. д. Каково условие полного взаимного растворения двух жидкостей (без учета энтропии смешивания)? |
Сумма работ адгезии больше или равна сумме работ когезии |
Сумма работ адгезии меньше суммы работ когезии |
Отсутствие межфазного натяжения σЖ1Ж2 |
Большое пограничное (межфазное) натяжение σЖ1Ж2 |
|
8.9 |
Для границы двух несмешивающихся жидкостей пограничное или межфазное натяжение σЖ1Ж2 определяется правилом Антонова: Пограничное натяжение равно разности поверхностных натяжений жидкостей на границах с воздухом в условиях взаимного насыщения σЖ1Ж2 = σЖ1Г - σЖ2Г. Расположите предложенные органические кислоты в порядке снижения поверхностного натяжения на границе вода – кислота. |
Линолевая С18Н32О2 |
Линоленовая С18Н30О2 |
Олеиновая С18Н34О2 |
Рицинолевая (12-гидроксиолеиновая) С18Н34О3 |
|
8.10 |
Связь между адсорбцией на границе раствор – воздух растворенного вещества и его химической природой позволяет выделить три типа веществ: А – вещества с положительной адсорбцией ( Г> 0); Б – вещества с отрицательной адсорбцией (Г <О); В – поверхностно инактивные вещества (Г=О). К какому типу следует отнести предложенные вещества? |
Глюкоза |
Пропионовая кислота |
Хлорид калия |
Этиламин |
|
8.11 |
Известно эмпирическое правило: Одну и ту же поверхность лучше смачивает та жидкость, которая ближе по полярности к смачиваемому веществу (она сильнее с ним взаимодействует и имеет меньшее поверхностное натяжение). Как будут вести себя на тефлоновой поверхности следующие жидкости: А – вода; Б – подсолнечное масло; В – водный раствор моющего средства? |
Растекается отдельными островками |
Скатывается в капли |
Растекается по поверхности сплошным слоем |
- |
|
8.12 |
Уравнение изотермы адсорбции для границы раздела Твердое тело – газ вывел в 1917 году Ленгмюр. Математическое выражение выглядит так: |
|
|
|
- |
|
8.13 |
Для описания адсорбции на границе раздела Раствор – газ в 1876 году для разбавленных растворов Гиббс предложил следующее уравнение: |
|
|
|
- |
|
8.14 |
Для математического описания адсорбции из раствора на границе раздела Твердое тело – жидкость Бедекер, а позже Фрейндлих предложили следующее уравнение изотермы адсорбции: |
|
|
|
- |
|
8.15 |
Эмпирически установлено, что поверхностная активность увеличивается в 3 – 3,5 раза при удлинении углеводородной цепи на одно звено, (-СН2-) группу. Эта закономерность носит название правила… |
Бойля – Мариотта |
Траубе – Дюкло |
Нернста – Шилова |
Шульце – Гарди |
|
8.16 |
При адсорбции дифильных молекул ПАВ соблюдается Принцип независимости поверхностного действия: полярная группа втягивается в воду, а неполярный радикал выталкивается в неполярную фазу. Образующийся двухмерный адсорбционный слой носит название… |
Двойной электрический слой - ДЭС |
Поверхностно активный слой |
«Частокол Ленгмюра» |
Мономолекулярный слой |
|
8.17 |
Экспериментально установлено, что величина предельной адсорбции Г∞ ПАВ одного гомологического ряда не зависит от длины углеводородного радикала. Какие «объяснения» не удовлетворяют результатам эксперимента? |
Г∞ - это количество молей вещества, приходящееся на 1 м2 поверхности |
Поверхностное натяжение ПАВ – членов одного гомологического ряда увеличивается в 3 – 3,5 раза при удлинении углеводородной цепи на одно звено, (-СН2-) группу |
Площадь, занимаемая молекулой ПАВ в насыщенном слое, постоянна и не зависит от длины углеводородного радикала |
Молекулы на поверхности образуют сплошной мономолекулярный слой, причем полярная группа втягивается в воду, а неполярный радикал выступает в газовую фазу |
|
8.18 |
Теория мономолекулярной адсорбции Ленгмюра разработана для адсорбции на границе «газ – твердое». Какие положения отвечают этой теории? |
Адсорбированные молекулы удерживаются активными центрами |
Между адсорбированными молекулами действуют слабые силы межмолекулярного притяжения |
На поверхности адсорбента может образоваться только мономолекулярный слой адсорбтива |
Притяжение данной молекулы поверхностью не зависит от наличия в адсорбционном пространстве других молекул |
|
8.19 |
Правило уравнивания полярностей Ребиндера утверждает: Процесс адсорбции идет в сторону выравнивания полярностей фаз, и тем сильнее, чем больше первоначальная разность полярностей. Имеем систему: бензойная кислота – вода, На каком из предложенных адсорбентов будет сорбироваться бензойная кислота? |
Силикагель |
Парафин |
Тальк |
Кварцевый песок |
|
8.20 |
Правило уравнивания полярностей Ребиндера утверждает: Процесс адсорбции идет в сторону выравнивания полярностей фаз, и тем сильнее, чем больше первоначальная разность полярностей. Имеем систему бензойная кислота – бензол. На каком из предложенных адсорбентов будет сорбироваться бензойная кислота? |
Полиэтилен |
Бентонитовая глина |
Графит |
Силикатное стекло |
|
8.21 |
Какой механизм адсорбции положен в основу потенциальной теории адсорбции Поляни? |
Мономолекулярный |
Полимолекулярный |
Адекватный |
Иономообменный |
|
8.22 |
Какой вид изотермы адсорбции описывает теория адсорбции Поляни (1915 г.)? |
Параболический |
S - образный |
Линейный |
Синусоидальный |
|
8.23 |
На графике представлены различные виды изотерм адсорбции растворенных веществ на поверхности твердого адсорбента: Установите, какому реальному случаю соответствует каждая кривая? |
Мономолекулярная адсорбция ПАВ |
Полимолекулярная адсорбция ПАВ |
Растворитель адсорбируется намного лучше растворенного вещества |
Адсорбент способен поглощать молекулы растворителя |
|
8.24 |
Какой из адсорбентов не принадлежит к типичным неполярным адсорбентам? |
Парафин |
Силикагель |
Тефлон |
Сажа |
|
8.25 |
Пользуясь правилом Траубе – Дюкло, найти, во сколько раз поверхностная активность амилового спирта (С5Н11ОН) больше, чем этилового (С2Н5ОН) ? |
В 9 – 10,5 раз |
Примерно в 10 раз |
В 3 – 3,5 раза |
Примерно в 6,5 раз |
|
8.26 |
Гедройц установил, что на почвах и грунтах происходит обмен катионов. По сорбционной способности катионы располагаются в ряд, который называется… |
Электрохимическим |
Изоэлектронным |
Лиотропным |
Катионитным |
|
8.27 |
Какие явления и технологические процессы основаны на принципе ионного обмена? |
Умягчение и опреснение воды |
Осветление сахарных сиропов |
Образование рудных месторождений |
Разделение и очистка лекарственных веществ, витаминов, энзимов, протеинов и алкалоидов |
|
8.28 |
Условная емкость ионного обмена, это число молей (эквивалентов) солевых ионов, поглощенных 1 кг ионита при заданных значениях…. Укажите параметры раствора, от которых зависит ионообменная емкость. |
РН |
Эквивалентная концентрация (нормальность) раствора |
Ионный состав раствора |
рОН |
|
8.29 |
Какие определения отвечают понятию «обменный комплекс»? |
Системы с фиксированными ионами и подвижными противоионами |
Системы, обладающие двойным электрическим слоем |
Системы с двойным электрическим слоем, способные к обмену ионами во внешней обкладке |
Системы «твердое – раствор» |
|
8.30 |
Пользуясь приближенным выражением уравнения Гиббса, вычислите величину адсорбции пропанола при 15оС из водного раствора с концентрацией 0,12 моль/л, если σ(Н2О)=73,49×10-3 Н/м, σ(С3Н5ОН) = 63,3 ×10-3 Н/м. |
4,2×10-9 кмоль/м2 |
4,2×10-6кмоль/м2 |
4,2×10-6моль/см2 |
4,2×10-9кмоль/кг |