Тест Газовые законы и газовые смеси. Агрегатное состояние вещества
1.1 Какое утверждение не отвечает модели идеального газа?
- Частицы не имеют собственного объема
- Между частицами действуют межмолекулярные силы взаимодействия
- Все столкновения частиц упруги и не ведут к потере кинетической энергии
- Температура газа зависит от кинетической энергии поступательного движения его частиц
1.2 Какое свойство не присуще газам?
- Сжимаемость
- Текучесть
- Броуновское движение
- Поверхностное натяжение
- 1.3 Какие условия для газов считаются «нормальными»?
- Р=101,325 атм
- Т=298 К
- Р=760 мм рт. ст.
- Т=100оС
- Р=101,325 кПа
- Т=273,15 К
- Р=1,013 Па
- Т=0оС
1.4 Что подразумевается под приведением газа к нормальным условиям?
- Вычисление объема, занимаемого 1 моль газа
- Вычисление объема, который бы занимал газ при температуре 0оС и давлении 1 атм.
- Вычисление объема, который занял бы данный газ при температуре 298 К и 1 атм.
- -
1.5 При нормальных условиях 22,4 л это:
- 1 л воды в виде пара
- Объем 6,02 1023 молекул любого газа
- Молярный объем любого газа
- Объем 18 г воды в виде пара
1.6 Универсальная газовая постоянная равна R=![]() .Для каких условий она рассчитана?
.Для каких условий она рассчитана?
- Р=101,325 кПа
- Т=298 К
- Р=101,325 кПа
- Т=273,15 К
- Р=100 кПа
- Т=273,15 К
- Р=1 кПа
- Т=298 К
1.7 Какие размерности не присущи универсальной газовой постоянной?
- Дж/К
- Дж/кмоль К
- Л атм/моль К
- Па/моль К
1.8 В каких единицах измеряется давление и объем газовой системы, если численное значение универсальной газовой постоянной составляет:
- 0,082
- 8,314 103
- 62360
- -
1.9 Какая из формул отражает:
А) закон парциальных давлений Дж. Дальтона;
Б) закон диффузии Грэхема;
В) закон Менделеева – Клайперона;
Г) уравнение Ван-дер-Ваальса для реальных газов?
- Р =Σ рi
- PV = nRT
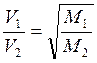
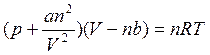
1.10 Что такое парциальное давление газа?
- Давление 1 моль газа
- Часть общего давления газовой смеси, которая приходится на долю данного газа
- Давление газа при нормальных условиях
- Давление, которым обладал бы газ, если бы при той же температуре занимал молярный объем
1.11 Газ собран над жидкостью. Каким будет измеренное давление?
- Больше истинного
- Меньше истинного
- Истинным давлением газа
- -
1.12 Как соотносятся между собой объемная (φ) и молярная (мольная) (χ) доли газов в смеси?
- Объемная больше
- Молярная больше
- Они равны
- -
1.13 Какой воздух тяжелее: сухой или влажный?
- Сухой
- Влажный
- Одинаковы по массе
- -
1.14 При водолазных работах используют «гелиевый воздух», в котором гелий заменяет азот. Какой гелиевый воздух тяжелее: сухой или влажный?
- Сухой
- Влажный
- Одинаковы по массе
- -
1.15 Объемные доли этилена и ацетилена в смеси равны. Как соотносятся между собой их массовые доли?
- Доля ацетилена больше
- Дoля этилена больше
- Они тоже одинаковы
- -
1.16 Даны газообразные вещества N2, СО, С2Н4. Как соотносятся между собой плотности этих веществ по воздуху?
- Она больше у азота
- Она больше у угарного газа
- Она больше у этилена
- Они равны
1.17 Какой объем занимает 1 моль воды при нормальных условиях?
- 18 л
- 22,4 л
- 18 мл
- 22,4 мл
1.18 Как изменится молярный объем газа при увеличении температуры от 30оС до 90оС при постоянном давлении?
- Увеличится в 3 раза
- Увеличится в 1,2 раза
- Уменьшится в 3 раза
- Не изменится, так как молярный объем зависит только от давления
1.19 Какая из указанных смесей всегда легче воздуха?
- Этилен и ацетилен
- Этан и водород
- Аммиак и кислород
- Гелий и аргон
1.20 В каком из перечисленных газов содержится больше всего атомов? (Объемы измерены при одинаковом давлении)
- В 7 л водорода Н2
- В 15 л Не
- В 6 л озона О3
- В 4 л метана СН4
1.21 Газовая смесь состоит 40 л азота и 10 л аммиака. Сколько атомов азота приходится на 1 атом водорода в этой смеси?
- 4
- 3
- 1/3
- 6,02 1023
1.22 Массовая и мольная доли кислорода в его смеси с неизвестным газом равны. Какое это вещество?
- Озон О3
- Пары воды
- Воздух
- Эквимолярная смесь Н2S и С2Н6
1.23 Взяты два сосуда одинакового объема. В один из них поместили аммиак, а в другой хлор. Массы газов одинаковы, давление тоже одинаково. Одинакова ли температура в сосудах?
- Одинакова
- В сосуде с хлором больше
- В сосуде с аммиаком больше
- -
1.24 Чему равно общее давление паров над системой из двух взаимно несмешивающихся жидкостей?
- Оно меняется в зависимости от состава смеси
- Оно постоянно и равно сумме парциальных давлений газов
- Оно равно сумме давлений насыщенных паров чистых жидкостей и постоянно во всем интервале концентраций
- -
Тесты основы термодинамики и термохимии - физической химии.
2.1 Укажите, какому определению соответствуют законы (начала) термодинамики:
А) Первое начало,
Б) Второе начало,
B) Третье начало?
- Все самопроизвольно протекающие процессы обязательно сопровождаются увеличением суммарной энтропии системы и ее окружения
- Энтропия чистых веществ, существующих в виде идеальных кристаллов, при температуре абсолютного нуля равна нулю
- Энергия может превращаться (переходить) из одного вида в другой, но не может исчезать или возникать.
- -
2.2 Математическое выражение первого закона термодинамики для изолированной системы в условиях:
А) изотермического процесса;
Б) изохорного процесса;
В) изобарного процесса.
- Q = ΔU
- Q = ΔH
- Q = A
- -
2.3 Физики, шутя, так сформулировали три закона термодинамики:
А) Первый закон,
Б) Второй закон,
В) Третий закон.
- Холодное тело не согреет горячее
- Разрушенное тело само не восстановится
- Любое тело вечно работать не может
- -
2.4 Установите соответствие!
А) Закон Лавуазье – Лапласа (1780);
Б) Закон Г. И. Гесса (1810);
В) Тепловой закон Нернста (1905);
Г) Постулат Клаузиуса.
- Тепловой эффект химической реакции не зависит от промежуточных стадий, а определяется только начальным и конечным состоянием системы
- Теплота не может переходить сама собой от более холодного тела к более горячему.
- Абсолютный нуль недостижим
- Теплота разложения данного химического соединения на простые вещества численно равна теплоте образования этого соединения из соответствующих простых веществ, но имеет обратный знак
2.5 Какие условия в термодинамике принято считать стандартными?
Р = 1 атм,
Т = 273 К
Р = 100 кПа,
Т = 298 К
Р = 1 бар
Т = 298 К
Р = 1,013 105 Па
Простые вещества находятся в устойчивых состояниях при 1 атм и 25оС
2.6 Стандартная молярная энтальпия образования различных соединений – это тепловой эффект образования 1 моля химического соединения из простых веществ, которые находятся в устойчивых при 1 атм и 298 К состояниях, при изобарном процессе ΔHo f, m (298) .
Какая запись соответствует стандартной молярной энтальпии образования воды?
ΔHom
{298 K, 2H2О (ж)} = -571,6 кДж/моль
ΔHom
{298 K, H2O (ж)} =
-285,8 кДж/моль
ΔHom
{298 K, H2O (г)} =
-241,8кДж/моль
-
2.7 Для каких процессов изменение стандартной молярной энтальпии положительно?
- Сгорание октана
- Конденсация пара
- Замерзание воды
- Электролиз воды
2.8 Дифференциальная теплота растворения – это количество теплоты, поглощающейся или выделяющейся при растворении…
- 1 моля вещества в 1 л растворителя
- 1 г вещества в 100 г растворителя
- 1моля вещества в некотором количестве чистого растворителя
- 1моля вещества в очень большом(300 моль/моль вещества) количестве растворителя
2.9 Какие из реакций образования оксидов азота могут протекать Самопроизвольно В стандартных условиях?
2N2 + O2 = 2N2O
ΔHo f, m (298) > 0
N2 + O2 = 2NO
ΔHo f, m (298) > 0
2NO2 = N2O4
ΔHo f, m (298) < 0
NO + NO2 = N2O3
ΔHo f, m (298) < 0
2.10 При каких условиях теплота реакции может быть оценена изменением энтальпии процесса?
Р = соnst
Р = соnst,
Т = соnst
V = соnst
Т = соnst,
V = соnst
2.11 Будут ли отличаться тепловые эффекты реакций, проведенные в равных условиях?
А) 2Н2(г) + О2(г) = 2Н2О(ж),
Б) 2Н2(г) + О2(г) = 2Н2О(г)
Нет, так как в обоих случаях продукт реакции - вода
Да, так как вода находится в разных агрегатных состояниях
Нет, так как в обоих случаях образуется 2 моля воды
-
2.12 Теплота сгорания моноклинной серы 70,975 ккал, а ромбической 70,900 ккал. Чему равны:
А) тепловой эффект перехода серы моноклинной в серу ромбическую,
Б) энтальпия этого перехода?
+75 кал
-75 кал
+141,87 ккал
-141,87 ккал
2.13 Какие операции необходимы при написании термохимических уравнений?
- Указание…
- Стехиометрических коэффициентов
- Агрегатного состояния всех веществ
- Стандартных энтальпий образования всех веществ
- Теплового эффекта (энтальпии) химической реакции
2.14 Стандартной молярной энтальпией нейтрализации ΔHo нейтр.,m (298) называется изменение энтальпии при образовании 1 моля воды в результате нейтрализации стандартных (С = 1 моль/л) растворов каких-либо кислоты и щелочи при 298 К и 1 атм. Она почти всегда равна -57,1 кДж/моль. В какой из приведенных реакций тепловой эффект нейтрализации
А) ΔHo нейтр.,m (298) >| -57,1|;
Б) ΔHo нейтр.,m (298) < |-57,1|;
B) ΔHo нейтр.,m (298) ≈ -57,1?
NaOH + HCl = NaCl + H2O
CH3COOH + NH4OH = CH3COONH4 + H2O
HClO4 + KOH = KClO4 ↓+ H2O
-
2.15 Для каких простых веществ значение стандартной молярной энтальпии образования ΔHo f, m (298) не равно нулю?
- О2(г)
- О3(г)
- С (графит)
- С (алмаз)
2.16 Энтальпия какой реакции отвечает стандартной молярной энтальпии образования ΔHo f, m (298) газообразного озона?
- 3 О(г) = О3 (г)
- 1,5 О2(г) = О3 (г)
- О2 (ж) + О(г) = О3(г)
- 2 О2(г) = О (г) + О3 (г)
2.17 Стандартная молярная энтальпия образования газообразного йодоводорода ΔHo f, m (298) = +24 кДж/моль. Какой реакции она соответствует?
- H (г) + I(г) = НI (г)
- 0,5 Н2(г) + 0,5 I2(г) = НI (г)
- Н(г) + 0,5 I 2(г) =
- НI (г)
- -
2.18 Энтальпия какой реакции соответствует стандартной молярной энтальпии образования ΔHo f, m (298) жидкой серной кислоты?
Н2SО4(г)=Н2SО4(ж)
ΔНo = -70кДж
Н2О(г) + SO3(г) = Н2SО4(ж)
ΔНo =-176 кДж
Н2(г) + 2О2(г) +
S (тв) = Н2SО4(ж)
ΔНo=-814 кДж
-
2.19 Экспериментальное значение ΔHo f (298) гидрирования бензола -208 кДж/моль, а вычисленное по энтальпиям связей -363 кДж/моль. Укажите причину расхождения результатов.
- Повышение устойчивости молекулы бензола за счет делокализации π - электронов
- Гидрирование бензола в эксперименте не осуществляется до конца
- Длины связей в бензоле отличаются от длины углерод – углеродных связей в этилене
- В молекуле бензола все три двойные связи сопряжены и отличаются по энергии от изолированных двойных связей в молекулах полиенов
2.20 Какое определение не отвечает содержанию понятия «энтропия»?
Энтропия – это мера…
- Перехода энергии в такую форму, из которой она уже не может Самопроизвольно Переходить в другие формы
- Изменения системы в максимально вероятном направлении
- Беспорядка (хаоса) в системе
- Теплового эффекта процесса
2.21 У какого вещества, первого или второго, при равных температуре и давлении и одинаковых агрегатных состояниях больше энтропия?
- О2 или О3
- С2Н6 или С2Н4
- С2Н4 или С2Н2
- Алмаза или графита
2.22 В сосуде, разделенном перегородкой, в обеих частях находятся равные количества газа А с энтропией каждой части SA при постоянной температуре. Чему равна энтропия всего газа после удаления перегородки?
- S = 2 SA
- S = SA
- S > SA
- ΔS = 2 n R ln2
2.23 В сосуде, разделенном перегородкой, в обеих частях находятся равные количества газов А и В с энтропией каждой части SA и SВ при постоянной температуре. Чему равна энтропия системы после удаления перегородки?
- S = SA + SB
- S > SA + SB
- ΔS = 2 n R ln2
- S < SA + SB
2.24 В каких процессах наблюдается рост энтропии?
- Растворение кристаллического вещества в жидкости
- Растворение газообразного вещества в жидкости
- Гидратация ионов в водных растворах
- Диссоциация ионных соединений при растворении в воде
2.25 Осуществление каких процессов с точки зрения второго закона термодинамики невозможно?
- Два вещества, начальные температуры которых различны, после контакта принимают одинаковое значение температуры
- Два газа, находящиеся в разных частях сосуда, разделенного перегородкой, равномерно перемешиваются после ее удаления
- Снижение концентрации растворенного вещества на границе раздела фаз: «раствор поверхностно активного вещества – воздух»
- Самопроизвольная диффузия растворителя через полупроницаемую мембрану из разбавленного раствора в концентрированный раствор
2.26 Энтропия – мера направленности процесса в изолированной системе:
А) ΔSo = 0;
Б) ΔSo > 0;
В) ΔSo < 0
- Реакция протекает слева направо
- Реакция протекает справа налево
- В системе наступило равновесие
- -
2.27 Значение энтропии, как известно, зависит от агрегатного состояния вещества. Укажите, для каких реакций значение ΔSoреакции > 0 ?
- 2О3 (г) = 3О2
- Cl2(г) + 5F2(г) = 2ClF5(г)
- SO2(г) + 2H2S(г) = 2S(тв) + 2H2O(ж)
- HgBr(тв) = Hg(ж) + Br2(ж)
2.28 Не производя вычислений, укажите, для каких процессов изменение энтропии в изолированной системе положительно?
- МgO(тв) + H2(г) = Mg (тв)+ H2O(ж)
- 4HCl(г) + O2(г) = 2Cl2 (г)+ H2O(г)
- С(графит) + СО2(г) = 2СО(г)
- СН3СООН(водн) = Н+(водн) + СН3СОО-(водн)
2.29 Мерой какого явления, протекающего в закрытой системе, служит термодинамическая функция состояния:
А) Энтальпия,
Б) Энтропия,
В) Энергия Гиббса?
- Необратимости процесса
- Теплового эффекта химической реакции
- Направленности процесса
- -
2.30 Какое определение не отвечает содержанию понятия «свободная энергия Гиббса»?
Свободная энергия Гиббса – это мера…
- Устойчивости химического соединения
- Связанной или утраченной энергии
- Самопроизвольной осуществимости процесса
- Энергии, доступной для выполнения работы
2.31 По значениям энергии Гиббса реакций определите, каким реактивом наиболее легко можно разрушить в водном растворе тетрайодмеркурат(П) – ион?
[HgI4]2- + S2- = HgS + 4I-
ΔGo298 = -127 кДж
[HgI4]2- + H2S + H2O = HgS + 2H3O+ + 4I-
ΔGo298 = -13 кДж
[HgI4]2- + 2OH - = HgO + 4I - + H2O
ΔGo298 = +26 кДж
-
2.32 Какая из реакций разложения комплексного иона не протекает при стандартных условиях?
[HgI4]2- + S2- = HgS + 4I-
ΔGo298 = -127 кДж
[HgI4]2- + H2S + H2O = HgS + 2H3O+ + 4I-
ΔGo298 = -13 кДж
[HgI4]2- + 2OH - = HgO + 4I - + H2O
ΔGo298 = +26 кДж
-
2.33 Энергия Гиббса связана с энтальпией и энтропией соотношением:
ΔG = ΔH - TΔS.
В каком из случаев
А) Реакция неосуществима при любых температурах,
Б) Реакция осуществима при любых температурах?
ΔH > 0
ΔS > 0
ΔH > 0
ΔS < 0
ΔH < 0
ΔS < 0
ΔH < 0
ΔS > 0
2.34 Проанализируйте значение свободной энергии Гиббса двух реакций и установите, какая из них более вероятна?
А) 4 NH3(г) + 3 O2(г) = 2 N2(г) + 6H2O (г)
Б) 4 NH3(г) + 5 O2(г) = 4NО (г) + 6H2O (г)
ΔGo298(NH3) =-16,7 кДж/моль;
ΔGo298(Н2О) = -228,6 кЖд/моль;
ΔGo298(NО) = +86,6 кДж/моль
А
Б
Они равновероятны
Обе реакции неосуществимы при нормальных условиях
235 Можно ли считать аммиачную селитру устойчивым соединением, если известно, что распад соли возможен по уравнению реакции:
NH4NO3 (кр) = N2(г) + 1/2O2(г) + 2H2O(г)
ΔGo298(NH4NO3) = -183,8кДж/моль;
ΔGo298(H2O(г)) = -228,6 кДж/моль
Можно, так как ΔGo298<0
Нельзя, так как ΔGo298>0
Можно, так как ΔGo298>0
Нельзя, так как ΔGo298<0
